|
学好中学化学的关键和方法
要想学好一门学科,就必须弄清该门学科的特点。化学这们以实验为基础的自然科学,它的显著特点就是需要记忆的东西特别多,化学实验的操作步骤及注意事项、化学实验现象、元素及其化合物的物理性质和化学性质、化学基本规律等都需要记忆,如果记不住这些知识,就等于没有学好化学。做任何类型的化学题,都必须以熟记有关的化学基本知识为前提。一切化学能力的培养也必须以熟记有关的化学基本知识为前提。显而易见,学好化学的关键是解决记忆的问题。因而寻找一种巧妙的记忆方法是很有必要的,也可以说是中学化学教学改革的重大课题之一。
传统的死记硬背的枯燥僵化的教学方法,已使我国青少年的身心健康受到了严重损害。据权威人士调查表明:在小学生中近视率高达10%左右,在中学生中高达40%左右!在大学生中高达90%以上!!教育必须改革,而且教育要健康发展只有改革才有出路。
学好任何学科的知识都首先必须具有“书山有路勤为径,学海无涯苦作舟”的精神,但在知识爆炸的当代,仅仅具有这种精神还是不够的。要想提高记忆效率,就必须根据某一学科的特点、记忆的规律,寻找巧妙的科学的记忆方法,下面我对记忆中学化学知识的问题谈一下几点:
一、要掌握科学的记忆规律
1、人脑记忆的奥秘
现代科学研究已经证明,外界信息通过人的感觉器官向大脑中传输的时候,大脑细胞中的突触所产生的电脉冲和神经递质沿着一定的神经通道传导。因为大脑中的化学物质,如蛋白质和核酸以及神经递质等是由碳(C)、氢(H)、氮(N)等元素组成的,这些“C-H”、“C-N”、乃至“C-C”是可以旋转的,因此在信息流的作用下,这些化合物的原子位置和化合物的结构就会发生变化,随着信息的传导便会在神经通道上作为一种化学印记显现出来。如果这种印记达不到一定的强度——一次刺激太弱或者反复刺激太少,则这些印记会随之消失,这样一来,瞬间记忆就不能转化为长久记忆。反之,如果一次刺激强度很大(如平常所说的“那次印象特别深刻”)或者反复记忆(如学生记忆汉字和英语单词),这样一来,就能形成很强的化学结构印记,则每当有关信息通过这个通道时,便可是这种结构印记所“记述”的情景重现出来。
2、坚定信念,锻炼记忆
一些心理学家认为,记忆的关键,在于要有“我能记着”这种自信心。高尔基说:“人的天赋就象火花,它既可能熄灭,也可能燃烧起来。”意志消沉,懒懒散散,遗传素质再优越,环境再好,也是无济于事的。人的记忆力强弱,固然与先天因素有关,但更重要的是环境的影响和个人的努力。肌肉越锻炼越发达,人的记忆力也是如此。我小的时候为了锻炼记忆里,我曾经记忆过圆周率,我记到了小数点后500位;81年高考结束以后,在家里休息了3天后,便开始背成语辞典,这不仅有效地锻炼了我的记忆力,而且使我的文字水平上了一个新台阶。为了挖掘我儿子的记忆潜力,从我儿子刚会说话开始,到4岁至,我教儿子背过了170多首诗词,当我儿子用2天时间背过了白居易的《琵琶行》后,我开始对我儿子的记忆能力充满了信心。我儿子上五年级的时候,我开始让他背成语辞典,平常时间每天1页,节假日每天2页,效果很好。我的儿子不是天才,但我要充分地挖掘他的记忆潜力,我坚信我的儿子会以优异的成绩考取重点大学。在教学实践中,我要求学生背我的化学诗歌,并向学生讲明了背化学诗歌的两大意义:一是锻炼记忆里;二是能学好化学知识。可谓是一举两得。所以学生很愉快地接受了我的建议,取得了很好的效果。希望同学们能根据各自的特点,实施挖掘自己的记忆潜力的方式。
3、合理安排时间,注意劳逸结合
我在做学生时就坚持这样一个观点:“想玩的时候就尽情地玩,学习的时候就要全身心投入。”我坚决反对古人的那种“头悬梁,锥刺骨”的做法,因为现代科学已经证明,在记忆的艰苦劳动中,一定时间的休息好比是记忆的润滑油,会加快储存信息的进程;而疲劳则会减弱脑细胞的活动能力,使接受、理解、记忆的能力变得迟钝。
4、直观刺激有助于记忆
科学实验证明,直观刺激有助于记忆。老师在课堂上作的演示实验,趣味化学实验,就是运用直观刺激的方法教学,同学们务必要仔细观察实验过程。
5、要注意将意义记忆和机械记忆结合起来
化学知识表面上看起来杂乱无章,而实质上很多知识有内在的联系,我们必须在老师的指导下寻找出各种内在的联系,把意义记忆和机械记忆结合起来,提高记忆效率。为此,要善于分析对比,综合归纳,简化记忆。比较是确定现实现象异同的一种思维过程,从比较中就能抓住事物的本质,突出矛盾的特殊性;比较又是概括的前提,只有通过比较,才能确定同类事物的共同特征,把这些事物联合为一组进行概括。
6、要善于与遗忘作斗争
记忆的敌人是遗忘,战胜遗忘这个敌人的唯一方法就是及时复习。
德国有一位著名的心理学家名叫艾宾浩斯(Hermann
Ebbinghaus,1850-1909),他在1885年发表了他的实验报告后,记忆研究就成了心理学中被研究最多的领域之一,而艾宾浩斯正是发现记忆遗忘规律的第一人。
记忆的保持在时间上是不同的,有短时的记忆和长时的记忆两种。而我们平时的记忆的过程是这样的(如图1):
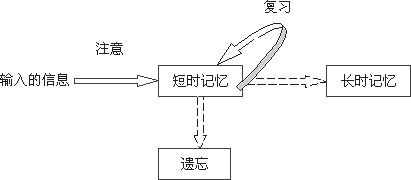
[图1]
输入的信息在经过人的注意过程的学习后,便成为了人的短时的记忆,但是如果不经过及时的复习,这些记住过的东西就会遗忘,而经过了及时的复习,这些短时的记忆就会成为了人的一种长时的记忆,从而在大脑中保持着很长的时间。那么,对于我们来讲,怎样才叫做遗忘呢,所谓遗忘就是我们对于曾经记忆过的东西不能再认起来,也不能回忆起来,或者是错误的再认和错误的回忆,这些都是遗忘。艾宾浩斯在做这个实验的时候是拿自己作为测试对象的,他得出了一些关于记忆的结论。他选用了一些根本没有意义的音节,也就是那些不能拼出单词来的众多字母的组合,比如asww,cfhhj,ijikmb,rfyjbc等等。他经过对自己的测试,得到了一些数据(如图2)。然后,艾宾浩斯又根据了这些点描绘出了一条曲线,这就是非常有名的揭示遗忘规律的曲线(如图3):艾宾浩斯遗忘曲线,图中竖轴表示学习中记住的知识数量,横轴表示时间(天数),曲线表示记忆量变化的规律。
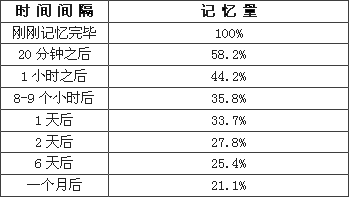
[图2]
艾宾浩斯遗忘曲线揭示出的遗忘规律是:遗忘在识记之后马上产生,进程是先快后慢,先多后少。根据这个记忆和遗忘规律,要自觉地与遗忘作斗争,具体要做到:一要及时复习,强化记忆,因为重复是记忆之母,与日常生活一样,经常见面的人你总是长久不忘,经常见面的知识,才能在你脑中根深蒂固。二要保持良好的心理状态,排除各种干扰因素。由于干扰而产生的临时遗忘是常见的。如:在考试时,因为紧张,本来记住的内容,一时怎么也回忆不起来,越急越想不起来,这就是一种情绪干扰。俄国著名教育家乌申斯基说:“如果教师充分认识到,神经系统是记忆机制的基础,就会明白健康的精神对正常记忆的作用”保持乐观镇静的情绪,心胸开朗、愉快乐观,则使人思维活跃,就可以增强学习和记忆能力。而焦虑不安、悲观失望、忧郁惶惑,会降低人的智力活动水平,影响记忆。
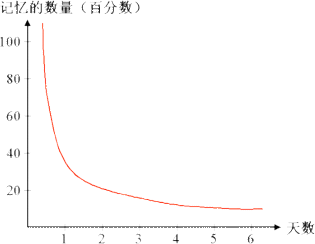
[图3]
二、巧用趣味记忆法
仅仅了解了记忆规律还是不够的,要取得事半功倍的效果,还必须善于发现和利用巧妙的记忆方法,我认为趣味记忆法就是巧妙的记忆方法中的一种。趣味的东西能引起兴趣,导致神经兴奋,激起学习动机,创造最佳的记忆心理状态,便于记忆,并能牢固保持。因此,我在做学生和当老师的时,非常喜欢趣味记忆法,并取得了显著的成效。趣味记忆的方法主要包括以下六种:
1、歌诀记忆法
歌诀记忆法就是针对需要记忆的化学知识利用音韵编成,融知识性与趣味性于一体,读起来琅琅上口,易诵易记;节约时间,效果明显。我创作的《中学化学诗歌》正是这种记忆方法。例如,关于托盘天平的使用,我编了这样一首八句诗,这样一来,用短短的八句诗就将托盘天平的主要构成部件、使用方法和注意事项明明白白地记住了。再如,对氢气还原氧化铜实验,我编了四句诗,这样一来,短短的四句诗就将氢气还原氧化铜实验的操作步骤和实验现象清清楚楚地记住了。
2、谐音记忆法
谐音记忆法就是要把需要记忆的化学内容跟日常生活中的谐音结合起来进行记忆。如地壳中各元素的百分含量前三位是“氧、硅、铝”,可谐北方音为“养闺女”。再如,金属活动顺序表后面四种金属是“铜、汞、银、铂、金”可谐音为:“统共一百斤”。谐音记忆法要根据自己的悟性和知识水平,在学习实践中创造。
3、会意记忆法
会意记忆法就是把一些抽象的概念进行自我理解和再加工处理,然后去巧记。如氢气或一氧化碳还原氧化铜的实验操作是:实验开始时,先通气后加热,实验结束时,先停止加热后停止通气。若用会意记忆法可会意记作,“气体早出晚归,酒精灯迟到早退。”
会意记忆法也要根据自己的悟性和知识水平,在学习实践中创造。
4、浓缩记忆法
浓缩记忆法就是针对一类化学知识或规律在深刻理解的基础上,可选取有代表性的字或词缩略成提纲挈须的骨架进行记忆。
若用浓缩记忆法可将实验室制氧气的七个实验步骤记为;“检、装、夹、点、收、移、熄。”“检”指检查装置是否漏气;“装”指往试管里装药品;“夹”指把试管夹在铁架台上;“点”指点燃酒精灯;“收”指收集气体;“移”指把导管先移出水面;“熄”指熄灭酒精灯。
再如我在那首过滤操作实验中,用的“三靠两低”也是采用了浓缩记忆法。
5、猜谜记忆法
猜谜记忆法就是把一些化学知识编成富有知识性、趣味性、生动形象幽默的谜语进行记忆。如记忆一氧化碳(CO)性质的谜语是:“左边月儿弯,右边月儿圆,弯月能取暖,圆月能助燃,有毒无色味,还原又可燃。”
6、联想记忆法
我在前面已经专门论述了运用联想记忆化学知识的方法和重要意义,在此就不重复了。
三、规律记忆法
各门学科都有一些规律性的东西,明智的人是善于发现和利用这些规律记忆知识。我认为,从某种意义上可以说,化学就是研究物质之间的相互反应一门自然科学。因而,总结化学反应的一些规律,并利用这些规律记忆化学知识,是至关重要的。现在向大家介绍几种常见的化学反应规律:
1、金属与足量非氧化性酸反应产生H2的规律:
⑴、当金属的原子个数(或物质的量)相等时,产生H2的量之比,等于金属所表现的化合价之比。如:将等物质的量的Na、Mg、Al分别与足量的稀硫酸反应时,产生的H2之比等于1:2:3。
⑵、当金属的质量相等时,产生H2的量之比,等于金属所表现的化合价除以其相对原子质量之比。如:将等质量的Na、Mg、Al分别与足量的盐酸反应时,产生的H2之比等于1/23
:
2/24 :3/27。
2、氧化还原反应规律
⑴、氧化剂与还原剂作为两种反应物反应时,总是氧化剂中某元素化合降低,该元素的原子(或离子)得到电子,该元素被还原,发生还原反应,产生还原产物;还原剂中某元素化合价升高,该元素的原子(或离子)失去电子,该元素被氧化,发生氧化反应,产生氧化产物。
⑵、通过氧化还原反应比较氧化性、还原性强弱:
强氧化剂与强还原剂总在反应里(方程式的左边);弱氧化剂与弱还原剂总在产物里(方程式右边)。即:一个自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;还原剂的还原性大于还原产物的还原性。
⑶、归中律:同种元素的不同价态相遇时,若要反应,则生成物中该元素的价态,必介于反应物中该元素的两种价态之间,如Fe3+和Fe反应,生成Fe2+(中间价态),SO2与H2S反应时,必然产生0价的S单质。若无中间价态则不反应。如H2SO4(浓)和SO2,Fe3+和Fe2+均不反应。
当然,有一种情况值得特别注意:一个氧化还原反应中,只有一种元素化合价变化,则一定是该元素处于中间价态的那种原子发生了化合价既升高又降低的自身氧还原反应。如:Na2O2与H2O(或CO2)反应时,由于氧元素-1价与-2价之间没有价态,所以是Na2O2中-1价的氧发生化合价既升高又降低的自身氧化还原反应。
⑷、反应次序:同一氧化剂和几种还原剂反应时,还原性最强的还原剂优先发生反应(直到用完)。
3、离子反应规律
溶液中只要能降低某些离子的浓度,这些离子就能发生离子反应。离子间若能组合成难溶物、气体、弱电解质(水、弱酸、氨水等),或相遇时能发生化合价升降的反应,则这些离子间就因反应而不能共存。
4、强电解质规律
强酸、强碱、和几乎所有的盐都是强电解质。
如:HCl、H2SO4、NaOH、Ba(OH)2、NH4HCO3、NaCl、BaSO4
、CaCO3等(在中学常见的盐是强电解质)。
5、某些分解反应的规律
⑴、碱的热稳定性
金属性越弱的金属所对应的碱越不稳定。如碱金属(金属性强)所对应的碱比较稳定,加热不易分解;碱土金属(第ⅡA族元素)所对应的碱在较高的温度下可以分解;而其它金属所对应的碱在不很高的温度下就可以分解。
⑵、碳酸盐的热稳定性
碱金属的碳酸盐比较稳定,其它碳酸盐、碱式碳酸盐受热易分解,酸式盐一般比正盐易分解。
⑶、硝酸盐的分解规律
在金属活动顺序表中,K到Na元素的硝酸盐热分解时,产生相应的亚硝酸盐和氧气;Mg到Cu元素的亚硝酸盐热分解时,产生相应的金属氧化物、NO2和O2
;Cu后面的(不含Cu)元素的硝酸盐热分解时,产生相应的金属、NO2和O2
。
6、某些“置换”规律
⑴、强酸能把弱酸从盐中置换出来,如:
H2SO4
+ 2CH3COONa = Na2SO4 + 2CH3COOH
⑵、不挥发性的酸能把挥发性的酸从盐中置换出来,如:
H2SO4
+ NaCI =
NaHSO4 + HCI↑
H3PO4
+ NaBr =
NaH2PO4 + HBr↑
⑶、在某些情况下某些弱酸能把强酸“置换”出来,如:
CuSO4
+ H2S =
CuS↓ + H2SO4 (因CuS不溶于H2SO4,所以该反应可以发生)
在此,要说明的一点的,化学中还有很多规律,我的《中学化学诗歌》的第四部分《杂诗集》正是从不同的的角度全方位地总结我掌握的一些化学规律性的东西。《金属活动性歌》是全面总结中学阶段所见的金属的物理性质规律和化学性质规律;《常见无机阳离子的鉴别》是全面总结中学阶段所见的无机阳离子鉴别的规律;《常见无机气体的鉴别》是全面总结中学阶段所见的常见无机气体的鉴别规律;《常见无机阴离子的鉴别》是全面总结中学阶段所见的常见无机阴离子的鉴别规律;《书写离子方程式应特别注意的问题》是全面总结中学阶段所见离子方程式书写的规律;《常见化学药品的贮存》是全面总结中学阶段所常见化学药品的贮存的规律;《常见无机盐的水溶性》是全面总结中学阶段所常见无机盐的水溶性的规律;《除掉杂质的方法》是全面总结中学阶段所见的除掉杂质的方法规律;《集气歌》是全面总结中学阶段所见气体的收集方法规律;《常见元素化合价》是全面总结中学阶段所常见元素化合价的规律;《元素周期律》是全面总结元素周期性变化规律;《原电池的判别》是全面总结原电池的判别的规律;顾名思义,《电解的一般规律》就是全面总结电解的一般规律;《推断题的解题思路》是全面总结推断题的解题思路规律……《杂诗集》的重要价值就是全面总结化学规律,而且用诗歌的形式表达,目的就是让学生在短时间内迅速掌握这些规律。
四、要科学地给大脑“加油”
科学家们研究发现,大脑细胞的记忆思维行为离不开核酸、蛋白质、乙酰胆碱等化学物质。美国图兰大学医学院的研究人员发现,人脑中的促肾上腺皮激素和促黑素细胞激素,不仅能促进人的记忆,而且还能增强注意力。接受这些化学物质的学生,在一系列工作中,比起对照组的学生,注意力容易集中,能较好地记住在他们面前闪过的几何图形。而对原来智力迟钝的患者,经注射这种药物以后,效果特别明显。为了反映这些化合物的奇妙特点,研究人员送给它一个非常动听的名字——“天才药”。研究人员认为,不同人之间学习工作能力的差别,可能关键就是大脑中的天然的“天才药”的多少决定的。科学研究还证明,当一个人对蛋白质的摄入量充足时,脑中的茶酚胺就会增加,去甲肾上腺素的传递就活跃。而去甲肾上腺素与大脑的思维和记忆能力关系十分密切。这种脑物质分泌传递越活跃,思维和记忆的能力就会越强。正因如此,日本在战后提倡更多地食用蛋白,特别是水产品蛋白,人体素质和寿命得到了很大提高。欧美国家在战后也争先恐后地实施“学生必须饮牛奶工程”,现在我国专家也建议在中等以上城市实施“学生饮豆奶工程”。
我根本不相信广告上说的任何关于健脑的“灵丹妙药”,即使有健脑的“灵丹妙药”,我也反对靠药物健脑的做法。我认为,每一个都都有自己固有的生理代谢平衡,靠食补可以有效地维持人体的生理代谢平衡;相反,靠药物健脑,就破坏了自己的生理代谢平衡。我在我儿子3岁的时候,就给他清理了“副食柜”,让他跟大人吃一样的饭,多吃蔬菜、水果和蛋白质类食物,结果我的儿子越来越聪明。人和动物一样,都来自于大自然,我认为大自然产生的蔬菜、水果和蛋白质是最好的健体(特别是健脑)的“良药”。
为了给你的大脑“加油”,我建议你多吃一些蛋白质类食品。
怎样作题效果好?
有很多同学稀里糊涂地一头扎进“题海”里,作了很多很多的练习题,但考试成绩却不很理想。这是为什么呢?是不是这些学生的智力有问题?不是的,是因为这些学生没有弄明白作题的目的和方法。作题目的是为了巩固所学的知识;加深对概念的理解和深化;找到解题规律和方法;发展思维,将知识转化为解决问题的能力。要达到此目的,适当多作一些练习题是有必要的,但关键并不在于多做题,而在于巧作题。怎样巧作题呢?
首先,要掌握做题步骤。解题有“三关”
1、审题关:要做到“三看清”,看清题中所讲的化学过程,看清题设条件,看清要解决的问题,这是解题的前提。
2、分析关:要做到“三想”,想化学过程所涉及的化学概念,所用到的化学原理,想所给条件与所求问题的关系,想有无隐含条件及题目考查的内容。
3、解答关:根据题意和条件,选择最佳的解题方法,如果用到其它学科知识、方法时,如公式变换,数据处理等要细心,最后还要对结果进行检验分析。
其次,解题后要总结,解题总结是提高做题效益最重要的环节。
主要包括:要弄明白命题者有什么意图?
题目设计的巧妙处何在?此题的关键何在?此题为什么这样作?作题过程中暴露了哪些弱点?通过作题你找到了什么样的解题规律和方法?这个问题改变设问角度,还会变成什么样的题目?等等。
最后,作题还要善于积累
积累包括两个方面,一是成功经验,二是失败教训。如果把平时练习和考试中做错的题目积累成集,并且经常翻阅复习,既有针对性,又节省时间,可大大提高学习效率。
巧解化学计算题解题方法概说
化学计算题是某些中学生感到比较头痛的一类题目,也是他们在考试中最最容易失分的一类题目,能选用最合适的方法准确而快速地解决计算题,对于增强学习效率,提高学习成绩,决胜考场,具有十分重要的意义。
选用合适的方法解计算题,不但可以缩短解题的时间,还有助于减小计算过程中的运算量,尽可能地降低运算过程中出错的机会。例如,下题有两种不同的解法,相比之下,不难看出选取合适方法的重要性:
[例1]:30mL一定浓度的硝酸溶液与5.12克铜片反应,当铜片全部反应完毕后,共收集到气体2.24升(S.T.P),则该硝酸溶液的物质的量浓度至少为
A.9mol/l
B.8mol/l
C.5mol/l
D.10mol/l
解法一:因为题目中没有指明硝酸是浓或稀,所以产物不能确定,根据铜与硝酸反应的两个方程式:
3Cu + 8HNO3(稀)=
Cu(NO3)2 +2NO↑
+ 4H2O…(1)
Cu+4HNO3(浓)
=
Cu(NO3)2 + 2NO2↑+2H2O
……(2)
可以设参与反应(1)的Cu为xmol,则反应生成的NO气体为2/3xmol,反应消耗的硝酸为8/3xmol;再设参与反应(2)的Cu为ymol,则反应生成的NO2气体为2ymol,反应消耗的硝酸为4ymol,从而可以列出方程组
(x+y)×64=5.12
[(2/3)x+2y]:×22.4=2.24
解之得x=0.045mol,y=0.035mol
则所耗硝酸为8/3x+4y=0.26mol,其浓度为(0.26/0.03)mol/l所以在8-9之间,只能选A.
解法二:根据质量守恒定律,由于铜片只与硝酸完全反应生成Cu2+,则产物应为硝酸铜,且其物质的量与原来的铜片一样,均为5.12/64=0.08mol。从产物的化学式Cu(NO3)2可以看出,参与复分解反应提供NO3-的HNO3有2×0.08=0.16mol摩;而反应的气态产物,无论是NO还是NO2,每一个分子都含有一个N原子,则气体分子总数就相当于参与氧化还原反应的HNO3的摩尔数,所以每消耗1mol摩HNO3都产生22.4L气体(可以是NO或NO2甚至是两者的混合物),现有气体2.24L,即有0.1molHNO3参与了氧化还原反应。故所耗硝酸为0.16+0.1=0.26mol,其浓度为(0.26÷0.03)mol/l,故在8-9之间,只能选A。
从以上两种方法可以看出,本题是选择题,只要求出正确结果,而不论方式及解题规范,而此题的关键之处在于能否熟练应用质量守恒定律,第二种方法运用了守恒法,所以运算量要少得多,也不需要先将化学方程式列出,配平,从而大大缩短了解题时间,更避免了因不知按哪一个方程式来求硝酸所导致的恐慌。再看下题:
[例2]:在一个6升的密闭容器中,放入3升X(气)和2升Y(气),在一定条件下发生下列反应:4X(气)+3Y(气)=2Q(气)+nR(气)
达到平衡后,容器内温度不变,混和气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n值是
A.3
B.4
C.5
D.6
解法一:抓住“X浓度减少1/3”,结合化学方程式的系数比等于体积比,可分别列出各物质的始态,变量和终态:
4X 3Y
2Q
nR
始态 3L
2L
0
0
变量
-1/3×3L=1L
;-3/4×1L=3/4L;
+2/4×1L=1/2L;
+n/4×1L=n/4L
终态 3-1=2L
2-3/4=5/4L
0+1/2=1/2L 0+n/4=n/4L
由以上关系式可知,平衡后(终态)混和气体的体积为(2+5/4+1/2+n/4)L,即(15+n)/4L,按题意“混和气体的压强比原来增加5%”即(15+n)÷4-5=5×5%,求得n=6。
解法二:选用差量法,按题意“混和气体的压强比原来增加5%”,即混和气体的体积增加了(2+3)×5%=0.25L,根据方程式,4X+3Y只能生成2Q+Nr,即每4体积X反应,总体积改变量为(2+n)-(4+3)
=
n-5,现有1/3×3L=1L的X反应,即总体积改变量为1L×[(n-5)/4]:=0.25L,从而也求出n=6。
解法三:抓住“混和气体的压强比原来增加5%”得出反应由X+Y开始时,平衡必定先向右移,生成了Q和R之后,压强增大,说明正反应肯定是体积增大的反应,则反应方程式中X与Y的系数之和必小于Q与R的系数之和,所以4+3<2+n,得出n>5,在四个选项中只有D中n=6符合要求,为应选答案。
本题考查的是关于化学平衡的内容,解法一是遵循化学平衡规律,按步就班的规范做法,虽然肯定能算出正确答案,但没有把握住“选择题不问过程只要结果”的特点,当作一道计算题来做,普通学生也起码要用5分钟完成,花的时间较多;解法二运用了差量法,以含n的体积变量(差量)来建立等式,虽然比解法一快了一些,但还是未能充分利用选择题的“选择”特点,用时要1分钟左右;解法三对平衡移动与体积变化的关系理解透彻,不用半分钟就可得出唯一正确的答案。
由此可见,在计算过程中针对题目特点选用不同的解题方法,往往有助于减少运算过程中所消耗的时间及出错的机会,达到快速、准确的目的。在中学阶段运用较多的解题方法通常有以下13种:
1、商余法
这种方法主要是应用于解答有机物(尤其是烃类)知道分子量后求出其分子式的一类题目。对于烃类,由于烷烃通式为CnH2n+2,分子量为14n+2,对应的烷烃基通式为CnH2n+1,分子量为14n+1;烯烃及环烷烃通式为CnH2n,分子量为14n,对应的烃基通式为CnH2n-1,分子量为14n-1,炔烃及二烯烃通式为CnH2n-2,分子量为14n-2,对应的烃基通式为CnH2n-3,分子量为14n-3,所以可以将已知有机物的分子量减去含氧官能团的式量后,差值除以14(烃类直接除14),则最大的商为含碳的原子数(即n值),余数代入上述分子量通式,符合的就是其所属的类别:
[例3]:某直链一元醇14克能与金属钠完全反应,生成0.2克氢气,则此醇的同分异构体数目为:
A.6个
B.7个
C.8个
D.9个
[解析]:由于一元醇只含一个-OH,每mol醇只能转换出1/2molH2,由生成0.2克H2推断出14克醇应有0.2mol,所以其摩尔质量为72g/mol,分子量为72,扣除羟基式量17后,剩余55,除以14,最大商为3,余为13,不合理,应取商为4,余为-1,代入分子量通式,应为4个碳的烯烃基或环烷基,结合“直链”,从而推断其同分异构体数目为6个。
2、平均值法
这种方法最适合定性地求解混合物的组成,即只求出混合物的可能成分,不用考虑各组分的含量。根据混合物中各个物理量(例如密度、体积、摩尔质量、物质的量浓度、质量分数等)的定义式或结合题目所给条件,可以求出混合物某个物理量的平均值,而这个平均值必须介于组成混合物的各成分的同一物理量数值之间;换言之,混合物的两个成分中的这个物理量肯定一个比平均值大,一个比平均值小,才能符合要求,从而可判断出混合物的可能组成。
[例4]:将两种金属单质混合物13g,加到足量稀硫酸中,共放出标准状况下气体11.2L,这两种金属可能是:
A.Zn和Fe
B.Al和Zn
C.Al和Mg
D.Mg和Cu
[解析]:将混合物当作一种金属来看,因为是足量稀硫酸,13克金属全部反应生成的11.2L(0.5摩尔)气体全部是氢气;也就是说,这种金属每放出1摩尔氢气需26克,如果全部是+2价的金属,其平均原子量为26,则组成混合物的+2价金属,其原子量一个大于26,一个小于26,代入选项,在置换出氢气的反应中,显+2价的有Zn,原子量为65,Fe原子量为56,Mg原子量为24,但对于Al,由于在反应中显+3价,要置换出1mol氢气,只要18克Al便够,可看作+2价时其原子量为27/(3/2)=18,同样假如有+1价的Na参与反应时,将它看作+2价时其原子量为23×2=46,对于Cu,因为它不能置换出H2,所以可看作原子量为无穷大,从而得到A中两种金属原子量均大于26,C中两种金属原子量均小于26。所以A、C都不符合要求;B中Al的原子量比26小,Zn比26大,D中Mg原子量比26小,Cu原子量比26大,故B、D为应选答案。
[例5]:有两种气态烃组成的混合气体0.1mol,完全燃烧得到0.16molCO2和3.6gH2O,下列说法正确的是:混合气体中(
)
A、一定有甲烷
B、一定是甲烷和乙烯
C、一定没有乙烷
D、一定有乙炔
[解析]:n(烃):n(C):n(H)=0.1:0.16:3.6/18×2=1:1.6:4
即混合平均分子式组成为C1.6H4。碳原子小于1.6的只有CH4,故A正确,由平均分子式可知,另一烃中的H原子为4,则一定无C2H6。答案为(A、C)
3、极限法(也叫值极法)
极限法与平均值法刚好相反,这种方法也适合定性或定量地求解混合物的组成。根据混合物中各个物理量(例如密度、体积、摩尔质量、物质的量浓度、质量分数等)的定义式或结合题目所给条件,将混合物看作是只含其中一种组分A,即其质量分数或气体体积分数为100%(极大)时,另一组分B对应的质量分数或气体体积分数就为0%(极小),可以求出此组分A的某个物理量的值N1,用相同的方法可求出混合物只含B不含A时的同一物理量的值N2,而混合物的这个物理量N平是平均值,必须介于组成混合物的各成分A、B的同一物理量数值之间,即N1<N平<N2才能符合要求,从而可判断出混合物的可能组成。
[例6]:某碱金属单质与其普通氧化物的混合物共1.40g,与足量水完全反应后生成1.79g碱,此碱金属可能是(
):
A.Na B.K C.Rb D.Li
[解析]:
本题若用常规思路直接列方程计算,很可能中途卡壳、劳而无功。但是如果将1.4g混合物假设成纯品(碱金属或氧化物),即可很快算出碱金属相对原子质量的取值范围,以确定是哪一种碱金属。假定1.4g物质全是金属单质(设为R),则:
R→ROH
△m
MR 17
1.40 (1.79-1.40)
解之得MR=61;
再假定1.40g物质全是氧化物
设为R2O,则:
R2O→2ROH
△m
2MR+16
+18
1.40 (1.79-1.40)
解之得MR=24.3
;
既然1.40g物质是R和R2O的混合物,则R的原子量应介于24.3-61之间。题中已指明R是碱金属,原子量介于24.3-61之间的碱金属只有钾,其式量为39。故答案为(B)。
[例7]:4个同学同时分析一个由KCl和KBr组成的混合物,他们各取2.00g样品配成水溶液,加入足够HNO3后再加入适量AgNO3溶液,待沉淀完全后过滤得到干燥的卤化银沉淀的质量,如下列四个选项所示,其中数据合理的是:
A.3.06g
B.3.36g
C.3.66g
D.3.96
[解析]:本题如按通常解法,混合物中含KCl和KBr,可以有无限多种组成方式,则求出的数据也有多种可能性,要验证数据是否合理,必须将四个选项代入,看是否有解,也就相当于要做四题的计算题,所花时间非常多。使用极限法,设2.00g全部为KCl,根据KCl-AgCl,每74.5gKCl可生成143.5gAgCl,则可得沉淀为(2.00÷74.5)×143.5=3.852g,为最大值,同样可求得当混合物全部为KBr时,每119克的KBr可得沉淀188g,所以应得沉淀为(2.00÷119)×188=3.160g,为最小值,则介于两者之间的数值就符合要求,故只能选B和C。
4.估算法
化学题尤其是选择题中所涉及的计算,所要考查的是化学知识,而不是运算技能,所以当中的计算的量应当是较小的,通常都不需计算出确切值,可结合题目中的条件对运算结果的数值进行估计,符合要求的便可选取。
[例8]:在一个6L的密闭容器种,放入3LX(g)和2LY(g),在一定条件下发生如下反应:
4X(g)+3Y(g)=
2Q(g)+nR(g),达到平衡后,容器温度不变,混合气体压强比原来增加5%,X的浓度减少1/3,则该反应式中的n值是
( )
A.3 B.4 C.5 D.6
[解析]:
本题可用一般解法,求出n的值,但步骤烦琐,若用估算法,结合选项,即可很快得出答案。
根据反应的化学方程式,“混合气体压强比原来增加5%,X的浓度减少1/3”,说明反应的正方向是体积增大的方向,即:4+3<2+n,n>5,选项中n>5的只有D。故答案为(D)
[例9]:已知某盐在不同温度下的溶解度如下表,若把质量分数为22%的该盐溶液由50℃逐渐冷却,则开始析出晶体的温度范围是:
温度(℃)
0 10 20 30 40
溶解度(克/100克水)
11.5
15.1
19.4
24.4 37.6
A.0-10℃
B.10-20℃
C.20-30℃
D.30-40℃
[解析]:本题考查的是溶液结晶与溶质溶解度及溶液饱和度的关系。溶液析出晶体,意味着溶液的浓度超出了当前温度下其饱和溶液的浓度,根据溶解度的定义,[溶解度÷(溶解度+100克水)]:×100%=饱和溶液的质量分数,如果将各个温度下的溶解度数值代入,比较其饱和溶液质量分数与22%的大小,可得出结果,但运算量太大,不符合选择题的特点。从表上可知,该盐溶解度随温度上升而增大,可以反过来将22%的溶液当成某温度时的饱和溶液,只要温度低于该温度,就会析出晶体。代入[溶解度÷(溶解度+100克水)]:×100%=22%,可得,溶解度×78=100×22,即溶解度=2200÷78,除法运算麻烦,运用估算,应介于25与30之间,此溶解度只能在30-40℃中,故选D。
5.差量法
差量法是依据化学反应前后的某些变化找出所谓的理论差量(固体质量差、溶液质量差、气体体积差、气体物质的量之差等),与反应或生成物的变化量成正比而建立的一种解题方法。此法将“差量”看作化学方程式右端的一项,将已知差量(实际差量)与化学方程式中的对应差量(理论差量)列成比例,其他解题步骤与按化学方程式列比例或解题完全一样。
[例10]:向50gFeCl3溶液中放入一小块Na,待反应完全后,过滤,得到仍有棕黄色的溶液45.9g,则投入的Na的质量为
:
A.4.6g B.4.1g C.6.9g D.9.2g
[解析]:
Na投入到FeCl3溶液发生如下反应:
6Na+2FeCl3+6H2O=6NaCl+2Fe(OH)3↓+3H2↑
若2mol
FeCl3与6molH2O反应,则生成6molNaCl,溶液质量减少82g,此时参加反应的Na为6mol;
现溶液质量减少4.1g,则参加反应Na应为0.3moL,质量应为6.9g。答案为C。
[例11]:同温同压下,某瓶充满O2共重116g,充满CO2时共重122g,充满某气体共重114g,则该气体相对分子质量为(
):
A.28 B.60 C.32 D.14
[解析]:
由“同温同压同体积下,不同气体的质量比等于它们的摩尔质量比”可知此题中,气体质量之差与式量之差成正比。因此可不计算本瓶的质量,直接由比例式求解:
(122-116)/(44-32)=(122-114)/(44-M(气体))
解之得,M(气体)=28。
故答案为(A)。
[例12]:在1升浓度为C摩/升的弱酸HA溶液中HA、H+和A-的物质的量之和为nC摩,则HA的电离度是:
A.n×100%
B.(n/2)×100%
C.(n-1)×100%
D.n%
[解析]:根据电离度的概念,只需求出已电离的HA的物质的量,然后将这个值与HA的总量(1升×C摩/升=C摩)相除,其百分数就是HA的电离度。要求已电离的HA的物质的量,可根据HA=H++A-,由于原有弱酸为1升×C摩/升=C摩,设电离度为X,则电离出的HA的物质的量为XC摩,即电离出的H+和A-也分别为Cx摩,溶液中未电离的HA就为(C-CX)摩,所以HA,H+,A-的物质的量之和为[(C-CX)+CX+CX]:摩,即(C+CX)摩=nC摩,从而可得出1+X=n,所以X的值为n-1,取百分数故选C。本题中涉及的微粒数较易混淆,采用差量法有助于迅速解题:根据HA的电离式,每一个HA电离后生成一个H+和一个A-,即微粒数增大1,现在微粒数由原来的C摩变为nC摩,增大了(n-1)×C摩,立即可知有(n-1)×C摩HA发生电离,则电离度为(n-1)C摩/C摩=n-1,更快地选出C项答案。
6.代入法
将所有选项的某个特殊物质逐一代入原题来求出正确结果,这原本是解选择题中最无奈时才采用的方法,但只要恰当地结合题目所给条件,缩窄要代入的范围,也可以运用代入的方法迅速解题。
[例13]:某种烷烃11克完全燃烧,需标准状况下氧气28L,这种烷烃的分子式是:
A.C5H12
B.C4H10
C.C3H8
D.C2H6
[解析]:因为是烷烃,组成为CnH2n+2,分子量为14n+2,即每14n+2克烃完全燃烧生成n摩CO2和(n+1)摩H2O,便要耗去n+(n+1)/2即3n/2+1/2摩O2,现有烷烃11克,氧气为28/22.4=5/4摩,其比值为44:5,将选项中的四个n值代入(14n+2):[3n/2+1/2]:,不需解方程便可迅速得知n=3为应选答案。
7.关系式法
对于多步反应,可根据各种的关系(主要是化学方程式,守恒等),列出对应的关系式,快速地在要求的物质的数量与题目给出物质的数量之间建立定量关系,从而免除了涉及中间过程的大量运算,不但节约了运算时间,还避免了运算出错对计算结果的影响,是最经常使用的方法之一。
[例14]:一定量的铁粉和9克硫粉混合加热,待其反应后再加入过量盐酸,将生成的气体完全燃烧,共收集得9克水,求加入的铁粉质量为:
A.14g
B.42g
C.56g
D.28g
[解析]:因为题目中没有指明铁粉的量,所以铁粉可能是过量,也可能是不足,则与硫粉反应后,加入过量盐酸时生成的气体就有多种可能:或者只有H2S(铁全部转变为FeS2),或者是既有H2S又有H2(铁除了生成FeS2外还有剩余),所以只凭硫粉质量和生成的水的质量,不易建立方程求解。根据各步反应的定量关系,可列出关系式:
Fe→FeS(铁守恒)→H2S(硫守恒)→H2O(氢守恒)……(1)
Fe→H2(化学方程式)→H2O(氢定恒)…………………(2)
从而得知,无论铁参与了哪一个反应,每1个铁都最终生成了1个H2O,所以迅速得出铁的物质的量就是水的物质的量,根本与硫无关,所以应有铁为9/18=0.5摩,即28克。
8.残基法
这是求解有机物分子结构简式或结构式中最常用的方法。一个有机物的分子式算出后,可以有很多种不同的结构,要最后确定其结构,可先将已知的官能团包括烃基的式量或所含原子数扣除,剩下的式量或原子数就是属于残余的基团,再讨论其可能构成便快捷得多。
[例16]:某有机物5.6克完全燃烧后生成6.72L(S.T.P下)二氧化碳和3.6克水,该有机物的蒸气对一氧化碳的相对密度是2,试求该有机物的分子式。如果该有机物能使溴水褪色,并且此有机物和新制的氢氧化铜混合后加热产生红色沉淀,试推断该有机物的结构简式。
[解析]:因为该有机物的蒸气对一氧化碳的相对密度为2,所以其分子量是CO的2倍,即56,而5.6克有机物就是0.1摩,完全燃烧生成6.72L(S.T.P)CO2为0.3摩,3.6克水为0.2摩,故分子式中含3个碳,4个氢,则每摩分子中含氧为56-3×12-4×1=16克,分子式中只有1个氧,从而确定分子式是C3H4O。根据该有机物能发生斐林反应,证明其中有-CHO,从C3H4O中扣除-CHO,残基为-C2H3,能使溴水褪色,则有不饱和键,按其组成,只可能为-CH=CH2,所以该有机物结构就为H2C=CH-CHO。
9.守恒法
物质在参加反应时,化合价升降的总数,反应物和生成物的总质量,各物质中所含的每一种原子的总数,各种微粒所带的电荷总和等等,都必须守恒。所以守恒是解计算题时建立等量关系的依据,守恒法往往穿插在其它方法中同时使用,是各种解题方法的基础,利用守恒法可以很快建立等量关系,达到速算效果。
[例17]:有一在空气中放置了一段时间的KOH固体,经分析测知其含水2.8%、含K2CO337.3%
取1克该样品投入25ml2摩/升的盐酸中后,多余的盐酸用1.0摩/升KOH溶液30.8ml恰好完全中和,蒸发中和后的溶液可得到固体:
A:1克
B:3.725克 C:0.797克
D:2.836克
[解析]:
本题化学反应复杂,数字处理烦琐,但若根据Cl-守恒,便可以看出:蒸发溶液所得KCl固体中的Cl-,全部来自盐酸中的Cl-,即:生成的n(KCl)=n(HCl)。
m(KCl)=0.025L×2mol/l×74.5g/mol=3.725g
答案为B。
[例18]:将KCl和KBr混合物13.4克溶于水配成500mL溶液,通入过量的Cl2,反应后将溶液蒸干,得固体11.175g则原溶液中K+,Cl-,Br-的物质的量之比为
( ):
A.3:2:1 B.1:2:3 C.1:3:2 D.2:3:1
[解析]:
:此题的解法有多种,但作为选择题,可以从答案中求解。原溶液中含有K+、Cl-、Br-,由电荷守恒可知:n(K+)=n(Cl-)+n(Br-),选项中符合这一关系式的只有答案(A)。
[例19]:将纯铁丝5.21克溶于过量稀盐酸中,在加热条件下,用2.53克KNO3去氧化溶液中Fe2+,待反应后剩余的Fe2+离子尚需12ml0.3摩/升KMnO4溶液才能完全氧化,则KNO3被还原后的产物为
( ):
A.N2 B.NO C.NO2 D.NH4NO3
[解析]:
根据氧化还原反应中得失电子的总数相等,Fe2+变为Fe3+失去电子的总数等于NO3-和MnO4-得电子的总数:
设n为KNO3的还原产物中N的化合价,则:
5.21g/56g/moL×(3-2)=0.012L×0.3mol/l×(7-2)+2.53g/101g/mol×(5-n)
解之得
n=3
故KNO3的还原产物为NO。
故答案为(B)。
[例20]:已知某强氧化剂[RO(OH)2]:+能被硫酸钠还原到较低价态,如果还原含
2.4×10-3mol[RO(OH)2]:-的溶液到低价态,需12mL0.2mol/l的亚硫酸钠溶液,那么R元素的最终价态为:
A.+3
B.+2
C.+1
D.-1
[解析]:因为在[RO(OH)2]:-中,R的化合价为+3价,它被亚硫酸钠还原的同时,亚硫酸钠被氧化只能得硫酸钠,硫的化合价升高了2价,根据2.4×10-3mol[RO(OH)2]:-与12ml×0.2mol/l=0.0024mol的亚硫酸钠完全反应,亚硫酸钠共升0.0024×2=0.0048价,则依照升降价守恒,2.4×10-3mol[RO(OH)2]:-共降也是0.0048价,所以每mol[RO(OH)2]:-降了2价,R原为+3价,必须降为+1价,故不需配平方程式可直接选C。
[例21]:(2000年春季高考25题)用1L10mol/lNaOH溶液吸收0.8molCO2,所得溶液中CO32-和HCO3-的物质的量浓度之比是(
)。
A.1:3 B.2:1
C.2:3
D.3:2
[解析]:设反应生成的NaCO3的物质的量为x,生成的NaHCO3的物质的量为y,则:
2x+y=10mol/l×1L(Na+守恒)
x+y=0.8mol(C守恒)
求出:x=0.2mol,y=0.6mol。
则
c(CO32-):c(HCO3-)=1:3,故应选A。
[例2]:(1999年上海高考题)
把0.02mol/lHAc溶液和0.01mol/lNaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是(
)。
A.c(Ac-)>c(Na+)
B.c(HAc)>c(Ac-)
C.2c(H+)=c(Ac-)-c(HAc)
D.c(HAc)+c(Ac-)=0.01mol/l
[解析]:此题实质上是0.05mol/l的HAc溶液和0.05mol/l的NaAc溶液的混合溶液。
由电荷守恒关系可得:
c(H+)+c(Na+)=c(Ac-)+c(OH-)…………(1)
由物料守恒关系可得:
c(HAc)+c(Ac-)=c(Na+)×2=0.01mol/l……(2)
由(2)可知D正确。
将(1)×2+(2)可得:
2c(H+)=c(Ac-)+2c(OH-)-C(HAc)%……(3)
故C选项错误。
[例22]:(1999年上海高考18题)将1.92gCu粉与一定量浓HNO3反应,当Cu粉完全作用时,收集到气体1.12L(标况),则所消耗的HNO3的物质的量是(
)。
A.0.12mol B.0.11mol
C.0.09mol
D.0.08mol
[解析]:由物料守恒1.92gCu和HNO3完全反应后,生成0.03molCu(NO3)2,即消耗HNO30.06mol;产生气体不管是NO2还是NO,均需HNO30.05mol。故共消耗HNO30.11mol。
选B。
[例23]:.(1999年全国高考23题)一定条件下NH4NO3受热分解的未配平的化学方程式为:
NH4NO3
=HNO3+N2+H2O
在反应中被氧化与被还原的氮原子数之比为(
)。
A.5:3 B.5:4 C.1:1
D.3:5
[解析]:根据得失电子守恒可得:
被氧化与被还原的氮原子数之比为5:3,选A。
10.规律法
化学反应过程中各物质的物理量往往是符合一定的数量关系的,这些数量关系就是通常所说的反应规律,表现为通式或公式,包括有机物分子通式、燃烧耗氧通式、化学反应通式、化学方程式、各物理量定义式、各物理量相互转化关系式等,甚至于从实践中自己总结的通式也可充分利用。熟练利用各种通式和公式,可大幅度减低运算时间和运算量,达到事半功倍的效果。
[例24]:120℃时,1体积某烃和4体积O2混和,完全燃烧后恢复到原来的温度和压强,体积不变,该烃分子式中所含的碳原子数不可能是:
A.1
B.2
C.3
D.4
[解析]:本题是有机物燃烧规律应用的典型。由于烃的类别不确定,氧是否过量又未知,如果单纯将含碳由1至4的各种烃的分子式代入燃烧方程,运算量大而且未必将所有可能性都找得出。应用有机物的燃烧通式,设该烃为CXHY,其完全燃烧方程式为:
CXHY+(X+Y/4)O2==XCO2+Y/2H2O
因为反应前后温度都是120℃,所以H2O为气态,要计体积,在相同状况下气体的体积比就相当于摩尔比,则无论O2是否过量,每1体积CXHY只与X+Y/4体积O2反应,生成X体积CO2和Y/2体积水蒸气,体积变量肯定为1-Y/4,只与分子式中氢原子数量有关。按题意,由于反应前后体积不变,即1-Y/4=0,立刻得到分子式为CXH4,此时再将四个选项中的碳原子数目代入,CH4为甲烷,C2H4为乙烯,C3H4为丙炔,只有C4H4不可能。
11.排除法
选择型计算题最主要的特点是,四个选项中肯定有正确答案,只要将不正确的答案剔除,剩余的便是应选答案。利用这一点,针对数据的特殊性,可运用将不可能的数据排除的方法,不直接求解而得到正确选项,尤其是单选题,这一方法更加有效。
[例25]:取相同体积的KI,Na2S,FeBr2三种溶液,分别通入氯气,反应都完全时,三种溶液所消耗氯气的体积(在同温同压下)相同,则KI、Na2S、FeBr2三种溶液的摩尔浓度之比是:
A.1:1:2
B.1:2:3
C.6:3:2
D.2:1:3
[解析]:本题当然可用将氯气与各物质反应的关系式写出,按照氯气用量相等得到各物质摩尔数,从而求出其浓度之比的方法来解,但要进行一定量的运算,没有充分利用选择题的特殊性。根据四个选项中KI和FeBr2的比例或Na2S和FeBr2的比例均不相同这一特点,只要求出其中一个比值,已经可得出正确选项。因KI与Cl2反应产物为I2,即两反应物物质的量的比为2:1,FeBr2与Cl2反应产物为Fe3+和Br2,即两反应物物物质的量比为2:3,可化简为2/3:1,当Cl2用量相同时,则KI与FeBr2之比为2:(2/3),即3:1,A,B,D中比例不符合,予以排除。只有C为应选项。如果取Na2S与FeBr2来算,同理也可得出相同结果。本题还可进一步加快解题速度,抓住KI、Na2S、FeBr2三者结构特点——等量物质与Cl2反应时,FeBr2需耗最多Cl2。换言之,当Cl2的量相等时,参与反应的FeBr2的量最少,所以等体积的溶液中,其浓度最小,在四个选项中,也只有C符合要求,为应选答案。
12.十字交叉法
十字交叉法是专门用来计算溶液浓缩及稀释、混合气体的平均组成、混合溶液中某种离子浓度、混合物中某种成分的质量分数等的一种常用方法,其使用方法为:
组分A的物理量a 差量c-b
平均物理量c(质量、浓度、体积、质量分数等)
组分B的物理量b 差量a-c
则混合物中所含A和B的比值为(c-b):(a-c),至于浓缩,可看作是原溶液A中减少了质量分数为0%的水B,而稀释则是增加了质量分数为100%的溶质B,得到质量分数为c的溶液。
[例26]:有A克15%的NaNO3溶液,欲使其质量分数变为30%,可采用的方法是:
A.蒸发溶剂的1/2
B.蒸发掉A/2克的溶剂
C.加入3A/14克NaNO3
D.加入3A/20克NaNO3
根据十字交叉法,溶液由15%变为30%差量为15%,增大溶液质量分数可有两个方法:(1)加入溶质,要使100%的NaNO3变为30%,差量为70%,所以加入的质量与原溶液质量之比为15:70,即要3A/14克;(2)蒸发减少溶剂,要使0%的溶剂变为30%,差量为30%,所以蒸发的溶剂的质量与原溶液质量之比为15%:30%,即要蒸发A/2克。如果设未知数来求解本题,则需要做两次计算题,则所花时间要多得多。
13.拆分法
将题目所提供的数值或物质的结构,化学式进行适当分拆,成为相互关联的几个部分,可以便于建立等量关系或进行比较,将运算简化。这种方法最适用于有机物的结构比较(与残基法相似),同一物质参与多种反应,以及关于化学平衡或讨论型的计算题。
[例27]:将各为0.3214摩的下列各物质在相同条件下完全燃烧,消耗氧气的体积最少的是:
A.甲酸
B.甲醛
C.乙醛
D.甲酸甲酯
[解析]:这是关于有机物的燃烧耗氧量的计算,因为是等摩尔的物质,完全可用燃烧通式求出每一个选项耗氧的摩尔数,但本题只需要定量比较各个物质耗氧量的多少,不用求出确切值,故此可应用拆分法:甲酸结构简式为HCOOH,可拆为H2O+CO,燃烧时只有CO耗氧;甲醛为HCHO,可拆为H2O+C,比甲酸少了一个O,则等摩尔燃烧过程中生成相同数量的CO2和H2O时,耗多一个O;同理可将乙醛CH3CHO拆为H2O+C2H2,比甲酸多一个CH2,少一个O,耗氧量必定大于甲酸;甲酸甲酯HCOOCH3拆为2H2O+C2,比乙醛少了H2,耗氧量必定少,所以可知等量物质燃烧时乙醛耗氧最多。
当然,解题方法并不仅局限于以上14种,还有各人从实践中总结出来的各种各样的经验方法,各种方法都有其自身的优点,在众多的方法中,无论使用哪一种,都应该注意以下4点:
一、要抓住题目中的明确提示。例如差值、守恒关系、反应规律、选项的数字特点、结构特点以及相互关系,并结合通式、化学方程式、定义式、关系式等,确定应选的方法。
二、使用各种解题方法时,一定要将相关的量的关系搞清楚,尤其是差量、守恒、关系式等不要弄错,也不能凭空捏造,弄巧成拙。
三、扎实的基础知识是各种解题方法的后盾,解题时应在基本概念基本理论入手,在分析题目条件上找方法,一时未能找到巧解方法,则要先从最基本方法求解,按步就班,再从中发掘速算方法。
四、在解题过程中,往往需要将多种解题方法结合同时运用,以达到最佳效果。
[例28]:有一块铁铝合金,溶于足量盐酸中,再用足量KOH溶液处理,将产生的沉淀过滤、洗涤、干燥、灼烧,使之完全变成红色粉末,经称量,发现该红色粉末和原合金质量恰好相等,则合金中铝的含量为:
A.70%
B.52.4%
C.47.6%
D.30%
[解析]:本题是求混合金属的组成,只有一个“红色粉末与原合金质量相等”的条件,用普通方法不能迅速解题。根据化学方程式,因为铝经两步处理后已在过滤时除去,可用铁守恒建立关系式:
Fe→FeCl2→Fe(OH)2→Fe(OH)3→(1/2)Fe2O3
再由质量相等的条件,得合金中铝+铁的质量=氧化铁的质量=铁+氧的质量,从而可知,铝的含量相当于氧化铁中氧的含量,根据质量分数的公式,可求出其含量为:[(3×16)/(2×56+3×16)]:×100%=30%。
在解该题中同时运用了关系式法、公式法、守恒法等。
综上所述,“时间就是分数,效率就是成绩”,要想解题过程迅速准确,必须针对题目的特点,选取最有效的解题方法,甚至是多种方法综合运用,以达到减少运算量,增强运算准确率的效果,从而取得更多的主动权,才能在测试中获取更佳的成绩。
对于一些重要的方法在下面再分别作详细地论述。
|